Page 23 - RADIOPROTECCION 94
P. 23
dad Modulada de Protones (IMPT) que per- miten depositar en cada ráfaga (proton spill) una intensidad diferente, en función de las heterogeneidades del tumor (Owen, 2014).
En el caso de fotones, las técnicas más
avanzadas son las denominadas Radiotera-
pias de Intensidad Modulada (IMRT o VMAT,
entre otras), las cuales utilizan diversos án-
gulos, formas e intensidades variables para
tratar de conseguir que la resultante de la
dosis se adapte a la geometría del tumor.
Con estos métodos se alcanza una cobertura
del tumor, en términos de dosis, equiparable
a la obtenida mediante protones, sin embar-
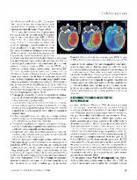
go, la dosis no deseada en los tejidos sanos a su alrededor es sustancialmente mayor. A título de ejemplo, en la Figura 4 se incluye la planificación del tratamiento de un tumor cerebral mediante protones (PBS), fotones (VMAT), y la diferencia de dosis integral entre ambos tratamientos (Di- ff.). Como se puede observar, tanto con fotones como con protones se consigue llegar a la dosis y conformación del tumor, pero con el uso de fotones los tejidos sanos reci- ben una dosis importante no deseada, lo que podría incre- mentar la toxicidad y efectos secundarios en el paciente, y afectar a su calidad de vida (Baumann, 2016). En definitiva, más de un siglo después de comenzar los tratamientos de radioterapia, los riesgos de dosis innecesarias están identi- ficados y contrastados (Lomax, 2013):
1. El riesgo de desarrollo de cánceres secundarios motiva- dos por el tratamiento disminuye con la dosis integral. A menor dosis menor probabilidad.
2.En algunos tumores cercanos al corazón la dosis innece- saria se reduce significativamente empleando protones, disminuyendo la probabilidad de los conocidos efectos perjudiciales que la radiación tiene sobre el corazón o los pulmones.
3.En tumores pediátricos, una menor dosis integral reduce de forma significativa los riesgos de crecimiento anormal y las dificultades de desarrollo intelectual.
4.En tumores cerebrales en adultos, una menor dosis re- duce la probabilidad de problemas asociados a la pérdi- da de memoria y capacidades intelectuales.
5.En general, una menor dosis está asociada con una me- nor toxicidad, mayores tasas de supervivencia y calidad- de vida superior de los pacientes.
Así pues, aunque en radioterapia podrían utilizarse dife-
rentes tipos de partículas y radiaciones, sin embargo en la actualidad el 99% de los tratamientos son realizados con fotones, pues como en su origen los equipos eran relativa- mente sencillos de implementar y significativamente más económicos, la mayoría de las instalaciones existentes hoy en día son de radioterapia convencional mediante fotones/ electrones (zubizarreta, 2017). Sin embargo los protones aportan ventajas importantes en el tratamiento de cada vez más tipos de tumores, mientras que las partículas,
Figura 4. Comparativa de dosis con protones (PBS), fotones (VMAT) y diferencia de dosis entre ambos (Diff.) (Baumann, 2016).
como iones de carbono 12, también podrían tener pres- taciones superiores en algunos casos. En definitiva, cada tipo de radioterapia tiene sus ventajas e inconvenientes. El modelo ideal sería utilizar sistemas dosimétricos de planifi- cación de radioterapia, robustos y fiables que permitieran al equipo físico-médico estudiar y simular virtualmente las dosis integrales con cada tipo de radiación, maximizando la dosis sobre los tejidos tumorales a eliminar, reduciendo al mínimo la dosis sobre tejidos sanos y órganos vitales, teniendo en cuenta para ello las diferentes características físicas y radiobiológicas de fotones, protones y partículas pesadas.
El DEsarrollo y ExPansión DE los cEntros DE ProtontEraPia
La visión de Robert Wilson en 1946 de utilizar protones en radioterapia fue realmente innovadora, sin embargo la puesta en práctica de dicha idea hubo de esperar hasta el año 1954 pues implicaba unos requerimientos tecnológi- cos que no estaban disponibles en ese momento. El tra- tamiento de tumores mediante radioterapia requiere par- tículas que puedan atravesar espesores de tejido humano de entre 5 cm y 32 cm, de forma que durante cada ciclo la dosis depositada en la zona tumoral se aproxime a 2 Gy·- min-1. Por lo tanto, desde el punto de vista tecnológico, de acuerdo con los valores del rango de protones, sería ne- cesario obtener corrientes con intensidades típicas de 108 partículas·min-1 y energías cinéticas en el intervalo de 70 MeV a 230 MeV, que implican velocidades de casi 180000 km/s, un 60 % de la velocidad de la luz (Gottschalk, 2012). Así pues, la aplicación de protones y partículas pesadas al tratamiento del cáncer mediante radioterapia ha requerido de importantes avances y desarrollos en el campo de los aceleradores de partículas que podrían agruparse en tres grandes fases (Amaldi, 2015).
En una primera fase, fase de investigación, que abarca- ría el período comprendido entre los años 1954 y 1983, las únicas instalaciones que cumplían los requisitos técnicos
Colaboraciones
LOS NUEVOS CENTROS DE PROTONTERAPIA EN ESPAÑA
23